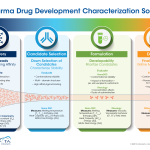
制药开发需要在研究、开发和制造的每个阶段进行严格的测试。必须优化新配方的稳定性和生物利用度,以实现成功的药物递送和治疗。对先导物原料药、辅料和杂质进行仔细测量,并创造工艺条件以满足严格的质量控制标准。
包括差示扫描量热仪 (DSC) 和热重分析仪 (TGA) 在内的热分析技术可检测由药物成分和条件引起的微小转变。差示扫描量热仪可以检测玻璃态转化、熔化和结晶,而热重分析可以提供重量变化温度和重量变化量。流变仪用于测量药物的粘度,这对注射药的递送或外用药的施用至关重要。吸附分析 (SA) 可测量药物的水分吸收和相关转变。
将这些技术与 TRIOS Guardian 等直观软件相结合,将加速您实验室内的药物开发。凭借每台仪器上的众多解决方案和行业领先的功能,TA Instruments 提供的系统肯定会增强您的制药研究和生产能力。

应用解决方案
制药研究和发现是一个具有挑战性但有回报的过程,它会导致新药的产生并用于治疗疾病或临床状况。首先,研究人员必须找到在疾病中起作用的生物靶点,并能挑出来进行治疗。在先导物发现过程中,研究人员会发现一些可作为开发候选物进行测试的小分子或生物疗法。先导物优化和预配方涉及测试和改善先导物的关键特性,以便其能被适当吸收用于预期治疗。量热法用于表征大分子间的微小相互作用,气体分析和吸附分析用于测定药物化合物的热稳定性和水分含量。

| 差示扫描量热仪 (DSC) |
温度范围:-180℃ 至 725℃ |
| 吸附分析 (SA) |
湿度控制范围:0 % 至 98% RH |
| 热重分析仪 (TGA) |
逸出气体分析 (EGA)
温度范围:室温至 1500 ℃ |
| Nano ITC |
温度范围:2 ℃ 至 80 ℃ |
药物配方和开发需要高度准确的生物分子表征,以预测其在身体中的行为及其治疗功效。必须测试原料药 (API) 及其非活性载体或辅料的相容性和化学稳定性。也针对人体内的生物利用度优化了药物开发。流变学有助于开发人员测量药物生产过程中液体的流动行为,以及配方的粘度和屈服应力以保持药物悬浮。在外用软膏中,乳液稳定性得到优化,以防止相分离。吸附分析(SA) 用于评估吸湿性、无定形-结晶相变和水合物形成。

| 差示扫描量热仪 (DSC) |
温度范围:-180°C 至 550°C
|
| 吸附分析 (SA) |
湿度控制范围:0 % 至 98% RH |
| 流变学 |
温度范围:-150℃ 至 600℃
|
| 热重分析仪 (TGA) |
温度范围:30℃ 至 1200℃
|
药物配方通过初步测试后,会继续进行制造和质量控制评估。药物制造商会测试关键质量属性 (CQA) 并确定关键原辅料属性 (CMA),这些属性必须在整个生产过程中且直到药物到达消费者手中都要保持稳定。最终用户满意度还取决于药物递送和包装情况,必须对此进行测试以消除产品损坏。质量控制测试可检测任何批次间的差异,而制造故障排除和根本原因分析可帮助制造商确定其工艺中的问题。流变仪可测量关键属性,如注射药的粘度以及外用药的粘弹性和屈服应力,所有这些都会影响药物的递送。差示扫描量热仪(DSC)和热重分析仪(TGA)可检测热稳定性和产品变化,这有助于工艺和递送优化。

| 差示扫描量热仪 (DSC) |
温度范围:-180°C 至 550°C
|
| 流变学 |
温度范围:-150℃ 至 600℃
|
| 热重分析仪 (TGA) |
温度范围:30℃ 至 1200℃
|
| 吸附分析 (SA) |
湿度控制范围:0 % 至 98% RH |
成功的药用产品需要放大规模以满足消费者的需求,这需要严格的测试和工艺优化。制造商在设计放大生产时必须测试其工艺安全性并评估风险。热分析技术(包括 DSC、TGA 和动力学)可测量新设计制造系统中药用产品的热稳定性和相变。吸附分析可测量水分吸收,有助于优化加工系统,从而最大限度地减少对药物疗效的负面影响。

| 差示扫描量热仪 (DSC) |
温度范围:-180°C 至 550°C |
| 热重分析仪 (TGA) |
温度范围:30℃ 至 1200℃ |
- 研究和发现
-
制药研究和发现是一个具有挑战性但有回报的过程,它会导致新药的产生并用于治疗疾病或临床状况。首先,研究人员必须找到在疾病中起作用的生物靶点,并能挑出来进行治疗。在先导物发现过程中,研究人员会发现一些可作为开发候选物进行测试的小分子或生物疗法。先导物优化和预配方涉及测试和改善先导物的关键特性,以便其能被适当吸收用于预期治疗。量热法用于表征大分子间的微小相互作用,气体分析和吸附分析用于测定药物化合物的热稳定性和水分含量。

差示扫描量热仪 (DSC) - 原料药或辅料的鉴定
- 原料药或辅料的表征
- 多态性或多晶态
- 玻璃态转化温度 (Tg)
- 熔化
- 熔解热
温度范围:-180℃ 至 725℃
吸附分析 (SA) - 水分吸附等温线和动力学
- 干燥和脱水
- 无定形含量
- 多态性
- 水合物形成和脱水
湿度控制范围:0 % 至 98% RH
热重分析仪 (TGA) - 热稳定性
- 氧化稳定性
逸出气体分析 (EGA)
- 杂质鉴定
- 成分分析
温度范围:室温至 1500 ℃
Nano ITC - 结合表征
- 用于靶点的原料药或药品的比较
温度范围:2 ℃ 至 80 ℃
- 药物配方和开发
-
药物配方和开发需要高度准确的生物分子表征,以预测其在身体中的行为及其治疗功效。必须测试原料药 (API) 及其非活性载体或辅料的相容性和化学稳定性。也针对人体内的生物利用度优化了药物开发。流变学有助于开发人员测量药物生产过程中液体的流动行为,以及配方的粘度和屈服应力以保持药物悬浮。在外用软膏中,乳液稳定性得到优化,以防止相分离。吸附分析(SA) 用于评估吸湿性、无定形-结晶相变和水合物形成。

差示扫描量热仪 (DSC) - 共晶相与纯度
- 相图
- 多态性或多晶态
- 通过测量比热容的变化(如有)来了解相容性和稳定性
- 转变 – Tg、熔点、熔解热
- 检测和定量无定形含量
温度范围:-180°C 至 550°C
吸附分析 (SA) - 通过吸湿性筛查评估水分稳定性
- 检测和定量无定形含量
- 评估湿度引起的无定形 – 结晶相变
- 鉴定水合物形成和脱水
湿度控制范围:0 % 至 98% RH
流变学 - 加工性
- 粘流曲线
- 剪切稀化
- 稳定性
- 零剪切粘度
- 屈服应力
- 粘弹性(G’和 G“)
温度范围:-150℃ 至 600℃
热重分析仪 (TGA) - 热稳定性和氧化稳定性
- 检测并定量溶剂和杂质
- 添加 EGA(MS 或 GC/MS)进行杂质鉴定
温度范围:30℃ 至 1200℃
- 制造、生产和质量控制
-
药物配方通过初步测试后,会继续进行制造和质量控制评估。药物制造商会测试关键质量属性 (CQA) 并确定关键原辅料属性 (CMA),这些属性必须在整个生产过程中且直到药物到达消费者手中都要保持稳定。最终用户满意度还取决于药物递送和包装情况,必须对此进行测试以消除产品损坏。质量控制测试可检测任何批次间的差异,而制造故障排除和根本原因分析可帮助制造商确定其工艺中的问题。流变仪可测量关键属性,如注射药的粘度以及外用药的粘弹性和屈服应力,所有这些都会影响药物的递送。差示扫描量热仪(DSC)和热重分析仪(TGA)可检测热稳定性和产品变化,这有助于工艺和递送优化。

差示扫描量热仪 (DSC) - 共晶纯度
- 多态性或多晶态
- 转变 – Tg、熔点、熔解热
- 检测和定量无定形含量
- 优化加工条件
- 质量控制
温度范围:-180°C 至 550°C
流变学 - 外用药
- 粘流曲线
- 剪切稀化
- 粘弹性模量(G’、G“)
- 屈服应力
- 注射药
- 粘流曲线
- 高剪切速率下的粘度
温度范围:-150℃ 至 600℃
热重分析仪 (TGA) - 检测并定量溶剂和杂质
- 添加 EGA(MS 或 GC/MS)进行杂质鉴定
- 质量控制
温度范围:30℃ 至 1200℃
吸附分析 (SA) - 评估储存稳定性
- 测量水分扩散和渗透性
湿度控制范围:0 % 至 98% RH
- 规模放大和工程化
-
成功的药用产品需要放大规模以满足消费者的需求,这需要严格的测试和工艺优化。制造商在设计放大生产时必须测试其工艺安全性并评估风险。热分析技术(包括 DSC、TGA 和动力学)可测量新设计制造系统中药用产品的热稳定性和相变。吸附分析可测量水分吸收,有助于优化加工系统,从而最大限度地减少对药物疗效的负面影响。

差示扫描量热仪 (DSC) - 通过给出有关工艺诱导转变的指示,确定并优化工艺参数
- 共晶纯度
- 多态性或多晶态
- 转变 – Tg、熔点、熔解热
- 冻干优化
温度范围:-180°C 至 550°C
热重分析仪 (TGA) - 确定放大混合物的成分准确性和均匀性
- 杂质检测
- 动力学
温度范围:30℃ 至 1200℃
- 通过给出有关工艺诱导转变的指示,确定并优化工艺参数
应用说明
- Apparent Melting: A New Approach to Characterizing Crystalline Structure in Pharmaceutical Materials
- Apparent Melting: A New Approach to Detecting Drug-Excipient Incompatibility
- Amorphous Content of Common Pharmaceutical Materials
- Characterization of Polymorphic Transitions in a Pharmaceutical by DSC and MDSC®
- Quantitative Determination of Amorphous and Crystalline Drug in Polymer Microspheres