关键词:差示扫描量热法、单克隆抗体 (mAb)、抗体药物产品、短期热稳定性、高通量、配方开发
MC178-CN
摘要
短期热稳定性测试对于确保产品质量和支持抗体药物产品的监管审批至关重要。TA Instruments™ RS-DSC (快速筛选差示扫描量热仪) 可对缓冲液配方和蛋白质序列修饰进行热稳定性筛选。该仪器提供的平台可同时分析多达 24 个配方强度浓度的样品。本应用说明提供的数据说明了在抗体药物产品开发中应用 TA Instruments RS-DSC 进行缓冲液短期热稳定性筛选和蛋白质修饰分析的实用性。
引言
了解抗体的结构功能关系是理解因溶液条件改变或序列修饰而导致的功能变异的基础。抗体结构表征是描述这些差异的重要一步。此外,评估生物分子在不同热条件下的稳定性对于确保这些药物的质量和监管审批至关重要。
差示扫描量热法 (DSC) 是一种热技术,用于了解抗体结构以及评估化合物的热应力耐受性。短期热稳定性是抗体药物产品评估中的一个关键质量属性。短期热稳定性是候选药物选择和预制剂中采用的关键指标,也是临床制剂开发中选择缓冲液成分 (包括赋形剂、缓冲盐、去污剂和 pH) 的重要参数。鉴于该筛选的性质,通常需要运行并分析数十到数百个样品。传统 DSC 的研究速度缓慢,一次只能测试一个样品,并且需要在样品之间进行仔细的清洁才能获得最佳结果。TA Instruments RS-DSC 是一个用于高通量热稳定性测试的全新的平台,可同时分析 24 个样品,重新定义了热稳定性测试领域。通过热分析提供快速、全面的理化信息,可降低新药上市的成本和时间。
抗体的 DSC 热图存在明显的多样性。一些抗体显示单个波峰,而其他抗体则显示多个不同的波峰,或显示重叠的波峰,表现为较大的解折叠峰上的肩峰。这些热图的变化被认为与铰链区域的灵活性相关[1]。对多结构域蛋白质的研究表明,这些复杂且重叠的波峰可能是结构域间相互作用的结果[2]。先进的 DSC 研究甚至成功确定了抗体重链部分内单个结构域的解折叠温度[3]。这些研究的最终目的是确定热稳定性,因为稳定性差会显著影响溶解度并导致聚集 – 这是生物治疗中的一个常见问题。

实验和方法
按照包装说明在组氨酸制剂缓冲液 (18.4 mg/mL 二水海藻糖、0.08 mg/mL 聚山梨酯 20、0.49 mg/mL 组氨酸 HCl、0.32 mg/mL 组氨酸,pH 6.0) 中制备 Herceptin™ 曲妥珠单抗 (Trastuzumab),浓度为 21 mg/mL,并在使用前在 4 °C 保存。为了在不同缓冲液中进行分析,使用 Amicon™ Ultra 10kDa 分子量截止离心式过滤器对抗体进行缓冲液交换。
硼酸盐缓冲液由 50 mM 硼酸、50 mM NaCl、2 mM EDTA (pH 8.0) 组成。PBS 是一种常见的工作缓冲液,由 Gibco™ DPBS 和 1 mM EDTA (pH 7.4) 组成。用于 KADCYLA™ (一种基于曲妥珠单抗抗体支架的抗体药物共轭物) 的琥珀酸盐配方缓冲液由 10 mM 琥珀酸钠、6% w/v 蔗糖 (pH 5.0) 组成。
用于突变筛选的抗体样品由 Cell Signaling Technology 设计并提供,并在 PBS (pH 7.4) 中配制成 20 mg/mL 的浓度以用于分析。
直接将蛋白质样品加入一次性玻璃微流控芯片 (MFC) 中,该芯片的通道可容纳 11 μL 液体样品。加入蛋白质溶液后,用背胶玻璃盖玻片密封微流控芯片,以在加热至 100°C 期间保留样品。将组装好的 MFC 放置在 TA Instruments RS-DSC 中每个双量热仪的样品侧 (图 1)。将可重复使用的聚醚醚酮 (PEEK) 芯片保留在参考侧。最多可同时运行 24 个样品,温度范围为 20 – 100 °C,预设扫描速率为 1 或 2 °C/分钟。由于无需在扫描之间进行清洁,因此在一个典型工作日内最多可运行 96 个样品。
使用由 RS-DSCRun 软件操作的 TA Instruments RS-DSC 时,每次扫描开始前都要在初始温度下平衡 1800 秒。每个样品一式三份,并在整个温度范围 (20 至 100 °C) 内以 1 或 2 °C/分钟的速度进行扫描。
为确保所有 24 个量热仪的准确性,首先使用二棕榈酰磷脂酰胆碱 (DPPC) 对仪器进行校准和验证,可接受的 Tmax 与预期文献值[4]的偏移应小于 0.2 °C。
使用 NanoAnalyze™ 软件 (v4.0.0) 处理数据。NanoAnalyze 软件的新功能可自动检测变性中点温度 (Tmax),并可对多达 96 个热图进行比较。NanoAnalyze 软件 v4.0.0 包括一种新的软件算法 RapidDSC,它将通过搜索指定数据范围内的峰值来自动检测 DSC 热分析图中的 Tmax。将自动基线应用于整个波峰,并用于进一步细化 Tmax 温度以提高准确性。自动波峰检测功能可在感兴趣温度范围内显示多达三个波峰。可在“基线和 Tmax 编辑器”弹出窗口中轻松编辑自动化功能,以缩小检测窗口、选择波峰识别的特定范围或调整自动基线和 Tmax。可导出 Tmax 自动化表格数据以方便比较,也可以在 RapidDSC 的 Tmax 可视化和叠加选项卡中查看。
在 NanoAnalyze 软件中进行手动分析,以便与使用 RapidDSC 自动检测到的 Tmax 进行比较。为与自动波峰检测功能进行手动比较,用活性样品池体积中蛋白质的摩尔数将每次扫描归一化为摩尔热容量。应用四阶或五阶多项式作为归一化数据的基线。目测估算 Tmax,并与每次转换的自动 Tmax 输出进行比较。如 “NanoDSC:选择基线和模型时的注意事项 (NanoDSC: What to Consider when Choosing a Baseline and Model)“中所述,可通过模型拟合进一步分析热图[5]。对于抗体稳定性分析,建议使用 Voigt 模型。
结果与讨论
配方缓冲液筛选
热稳定性是生物药品的关键质量属性。DSC 是用于表征溶液环境对蛋白质稳定性影响的主要工具。蛋白质稳定性受到溶液环境中一系列变量的影响,如 pH、缓冲液类型、离子强度、赋形剂和去污剂。可通过 Tmax 的小幅变化或高达数十度的较大变化来观察这些影响[6]。TA Instruments RS-DSC 考虑到生物制药业的需求,其并行通量设计有助于筛选生物蛋白药物的溶液条件,与
传统微量热法相比缩短了决策时间。
为展示配方筛选数据可如何帮助选择缓冲液成分,我们分析了抗体 Herceptin 曲妥珠单抗在四种常见缓冲液条件下的一式三份数据 (图 2 和表 1)。在本研究中,以约 20 mg/mL 的浓度筛选了不同配方缓冲液中的抗体;然而,TA Instruments RS-DSC 的独特设计可处理配方强度高于 330 mg/mL 的蛋白质浓度,从而可对未稀释药品进行热稳定性测试。如需了解更多信息,请参阅 TA Instruments 的应用说明“高浓度生物药物的快速热稳定性筛选 (Rapid Thermal Stability Screening of High Concentration Biologic Drugs)”[7]。
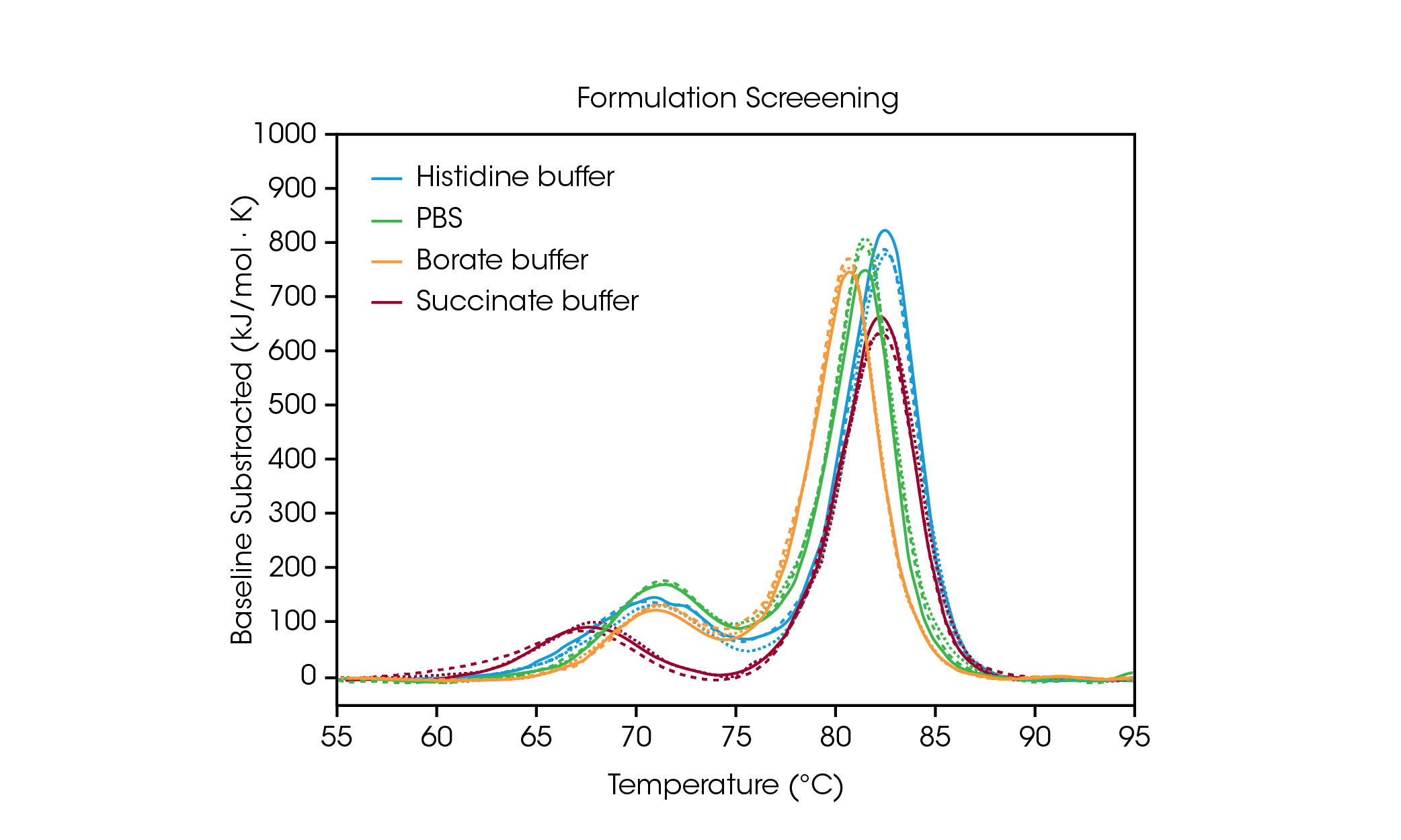
表 1. 配方筛选的转变温度。平均值 ± SD,n = 3。
| 缓冲液 | Tmax,1 (°C) | Tmax,2 (°C) |
|---|---|---|
| 组氨酸 | 70.76 ± 0.38 | 82.66 ± 0.09 |
| 硼酸盐 | 70.84 ± 0.08 | 80.69 ± 0.02 |
| PBS | 71.12 ± 0.06 | 81.48 ± 0.02 |
| 琥珀酸盐 | 67.71 ± 0.22 | 82.66 ± 0.08 |
组氨酸、硼酸盐或 PBS 缓冲液对第一个解折叠事件 (对应于 CH2 结构域的解折叠) 无显著影响[8]。然而,琥珀酸盐缓冲液会破坏 CH2 结构域的稳定性,导致解折叠起始时间和 Tmax,1 降低约 3 °C。对于反映 Fab 和 CH3 解折叠事件的主要转变,组氨酸和琥珀酸盐缓冲液的稳定性最佳,Tmax,2 为 82.66 °C。主要转变在硼酸盐缓冲液中最不稳定,Tmax,2 为 80.69 °C。与预期一致,在该样品组中,最稳定的曲妥珠单抗缓冲液配方是用于批准药物产品最终配方的组氨酸缓冲液。
为便于对配方筛选数据进行分析,NanoAnalyze 软件中的自动 Tmax 检测可在蛋白质稳定性筛选中准确检测多达三个转变。为证明波峰选取算法的准确性,将组氨酸制剂缓冲液中 50 mg/mL 曲妥珠单抗的自动 Tmax,1 和 Tmax,2 与手动波峰选择数据进行了比较,并在图 3 和表 2 中概述。在自动分析中,使用自动启动钩检测功能应用四阶基线多项式后检测到两个波峰,该功能无需指定相关温度范围。
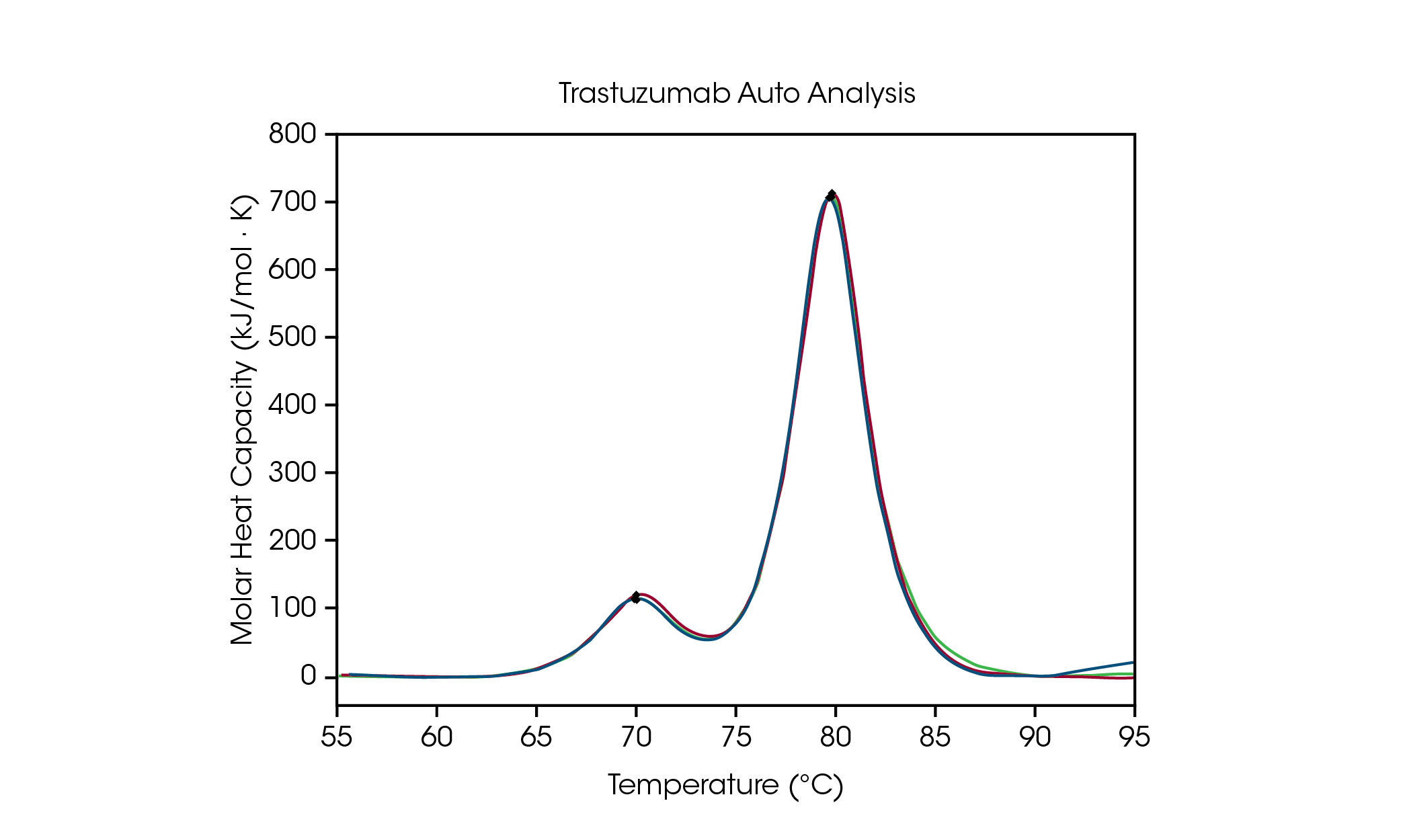
表 2. 曲妥珠单抗自动和手动 Tmax 检测的比较。
| 样品 | 自动 Tmax,1 (°C) | 手动 Tmax,1 (°C) | 自动 Tmax,2 (°C) | 手动 Tmax,2 (°C) |
|---|---|---|---|---|
| 重复 1 | 71.93 | 72.04 | 82.92 | 82.88 |
| 重复 2 | 71.81 | 71.93 | 82.76 | 82.75 |
| 重复 3 | 71.93 | 71.97 | 82.90 | 82.83 |
| 平均值 | 71.89 ± 0.07 | 71.98 ± 0.06 | 82.86 ± 0.09 | 82.82 ± 0.07 |
CH2 结构域解折叠的自动 Tmax,1 为 71.89 °C,手动波峰分析的 Tmax,1 为 71.98 °C °C。主要转变的自动 Tmax,2 为 82.86 °C,手动波峰分析的 Tmax,2 为 82.82 °C。观察到曲妥珠单抗具有极好的重现性。在一式三份的测试中,使用手动和自动波峰分析观察到的两个波峰的 Tmax 均在仪器精度范围 ± 0.2 °C 之内。 始终建议进行目视检查,以确保全面了解数据。该数据集表明,自动化 DSC 分析功能可准确检测多转变热图中的 Tmax。
序列修饰的筛选
蛋白质突变是优化蛋白质结构和功能的常用策略,即使是单个氨基酸修饰也可对蛋白质的整体稳定性产生可测量的影响。DSC 可用于了解突变对蛋白质热稳定性的影响,有助于指导生物药物开发流程中的决策制定。为证明序列修饰对稳定性的影响类型,我们筛选了一小组工程抗体,以检测蛋白质序列中单个氨基酸突变所导致的热解折叠变化 (图 4 和表 3)。
在亲本抗体中,CH2、Fab 和 CH3 结构域的解折叠包含在 Tmax 为 75.92 °C 的一个主要热转变内。对亲本蛋白进行单个氨基酸突变,该突变对短期热稳定性无重大影响 (突变 1),Tmax 为 75.52 °C。然而,额外的单氨基酸突变对蛋白质的稳定性存在显著影响 (突变 2 和突变 3)。在突变 2 中观察到一个明显的肩峰的存在,可能对应于 CH2 结构域的不稳定性,增加的 Tmax,1 为 70.04 °C,并且相对于亲本蛋白,主要转变发生小幅变化,Tmax,2 为 75.14 °C。突变 3 严重破坏了 CH2 结构域的稳定性,导致出现一个完全额外的解折叠峰,Tmax,1 为 64.85 °C。主要转变相对未受影响,Tmax,2 为 75.29 °C。正如突变 3 中所显示的显著不稳定性,修饰并不总是具有相同的效果,而是取决于修饰的位点以及新氨基酸的理化性质。通过蛋白质的结构稳定性优化序列修饰所需的功能优势,有助于理解结构与功能之间的关系,并可促进先进疗法的开发。
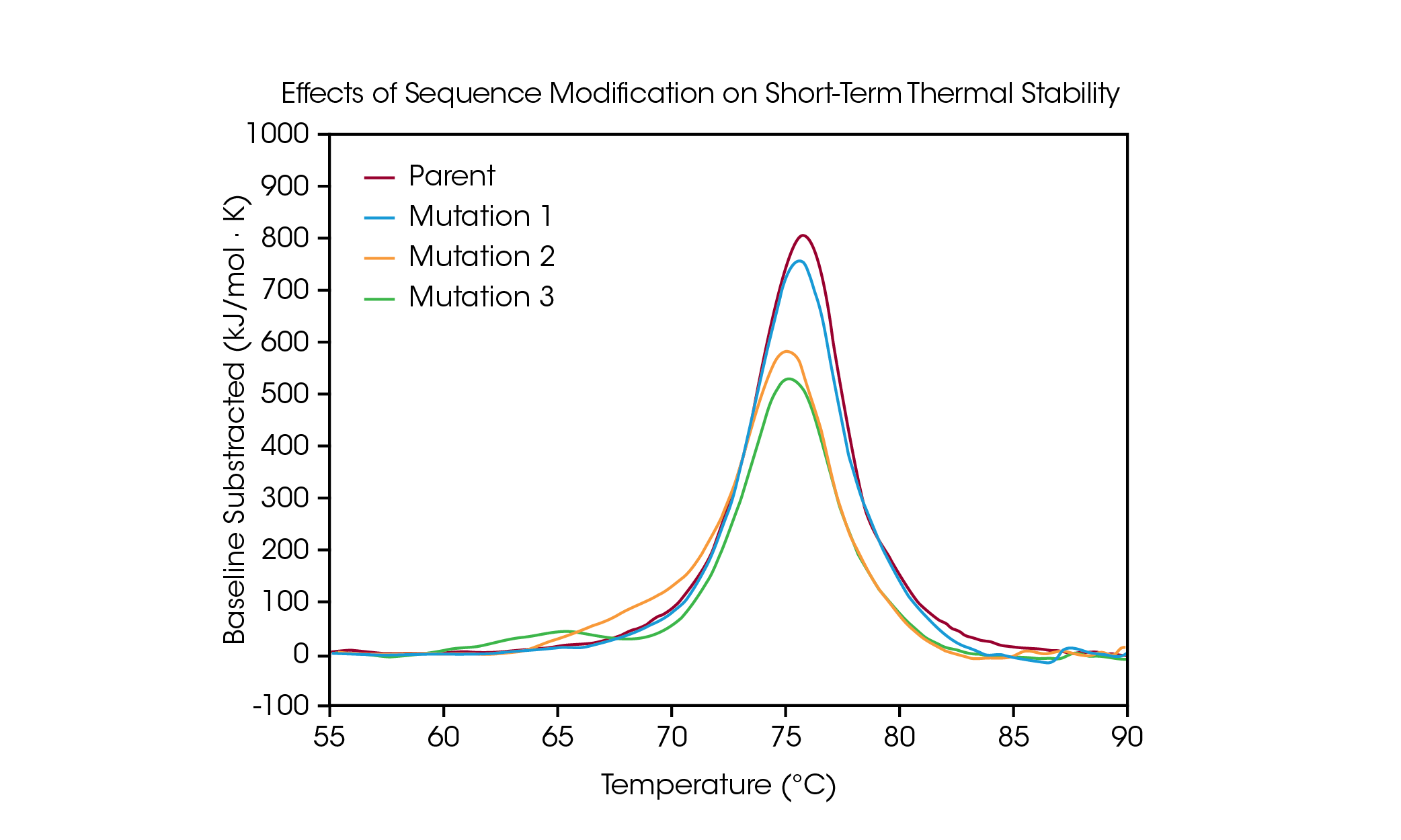
表 3. 突变筛选的转变温度。平均值 ± SD,n = 3。*通过 Voigt 模型确定。
| 样品 | Tmax,1 (°C) | Tmax,2 (°C) |
|---|---|---|
| 亲本 | — | 75.92 ± 0.15 |
| 突变 1 | — | 75.52 ± 0.14 |
| 突变 2 | 70.04 ± 0.86* | 75.14 ± 0.06 |
| 突变 3 | 64.85 ± 0.05* | 75.29 ± 0.06 |
结论
筛选溶液环境和序列修饰对短期热稳定性的影响对于开发高质量的药品至关重要。TA Instruments RS-DSC 通过同时测试多达 24 个样品来实现热稳定性的高通量筛选,进而可显著缩短决策时间。在此,我们展示了对复杂的多转变抗体样品进行准确且可重复的分析,以及快速确定缓冲液成分和突变对蛋白质整体结构的影响。数据处理软件 NanoAnalyze 中的新算法有助于分析目前可通过高通量筛选获得的大量的热数据。总之,TA Instruments RS-DSC 提供了一个用于表征抗体药物产品稳定性的全新的平台,这是了解热应力耐受性、产品质量以及支持监管审批的重要变量。
参考文献
- V.T. Oi, T. M. Vuong, R. Hardy, J. Reidler, J. Dangl, L. A. Herzenberg and L. Stryer, “Correlation between segmental flexibility and effector function of antibodies,” Nature, vol. 307, pp. 136-140, 1984.
- P.L. Privalov and S. A. Potekhin, “Scanning microcalorimetry in studying temperature-induced changes in proteins,” Methods in Enzymology, vol. 131, pp. 5-51, 1986.
- J.Wen, Y. Jiang and L. Nahri, “Effect of Carbohydrate on Thermal Stability of Antibodies,” American Pharmaceutical Review, vol. 11, p. 98, 2008.
- “Standard Practice for Calibration of Fixed-Cell Differential Scanning Calorimeters,” ASTM E2603-15, 2023.
- “NanoDSC: What to Consider when Choosing a Baseline and Model,” TA Instruments, MC154.
- C.M. Johnson, “Differential scanning calorimetry as a tool for protein folding and stability,” Archives of Biochemistry and Biophysics, vol. 531, pp. 100-109, 2013.
- “Rapid Thermal Stability Screening of High Concentration Biologic Drugs,” TA Instruments, MC177.
- K.J. Arlotta, A. V. Gandhi, H.-N.Chen, C. S. Nervig, J. F. Carpenter and S. C. Owen, “In-Depth Comparison of Lysine-Based Antibody-Drug Conjugates Prepared on Solid Support Versus in Solution,” Antibodies, vol. 7, p. 6, 2018.
单击此处以下载本应用说明的可打印版本。
